9
Алгоритмы решения задач по курсу химии для технических университетов
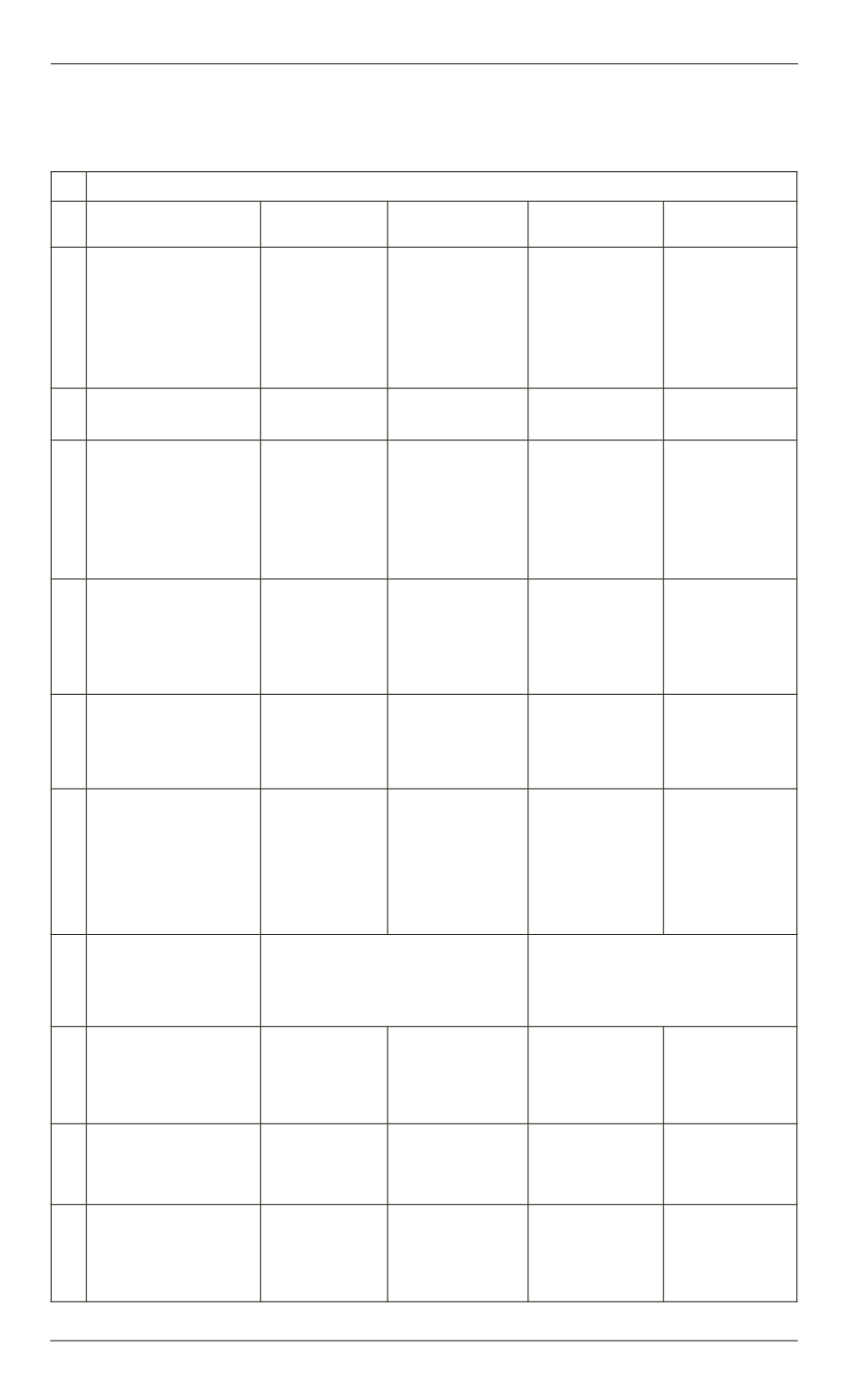
Пример.
Какой объем водорода образуется при взаимодействии
3,25 г цинка и 11 г соляной кислоты?
№
Zn + 2HCl = ZnCl
2
+ H
2
1 Агрегатное со-
стояние вещества
Тв.
Жидк.
Тв.
Газ
2
Вычислить мо-
лярные массы
веществ,
М
,
г\моль (для любо-
го агрегатного со-
стояния вещества)
65
36,5
136
2
3 Молярный объем
газов,
V
M
, л\моль
— —
— 22,4
4
Количественное
(молярное) соот-
ношение реаген-
тов (стехиометри-
ческие коэффици-
енты реакции )
1
2
1
1
5
Известное коли-
чество (масса,
г, или объем, л)
вещества по ус-
ловию задачи
3,25
11
y
х
6
Определить
количества реа-
гентов,
n
(Zn) и
n
(HCl), моль
3,2565 = 0,05 1136,5 = 0,3
— —
7
Нормировать
количества ве-
щества на сте-
хиометрические
коэффициенты
n
(Zn)
a
и
n
(HCl)
b
0,051 = 0,05 0,32 = 0,15
— —
8
Определить,
какое вещество
находится в не-
достатке
0,05
˂
0,15
Следовательно, количество
Zn меньше, чем количество
HCl. Расчет вести по Zn
—
9
Определить ко-
личества осталь-
ных участников
реакции,
n
, моль
0,05
2∙0,05 = 0,1 1∙0,05 = 0,05 1∙0,05 = 0,05
10
Определить мас-
сы неизвестных
веществ,
m
, г
— 0,1∙36,5 = 3,65 0,05∙136 = 6,8 0,05∙2 = 0,1
11
Определить объ-
ем неизвестных
веществ (при
н. у.),
V
, л
— —
—
0,1∙22,4 = 2,24


