8
Д.А. Сулегин, И.И. Юрасова
Построение диаграммы
Пурбе.
Нанесем полученные
потенциалы на поле диаграм-
мы в координатах φ =
f
(pH).
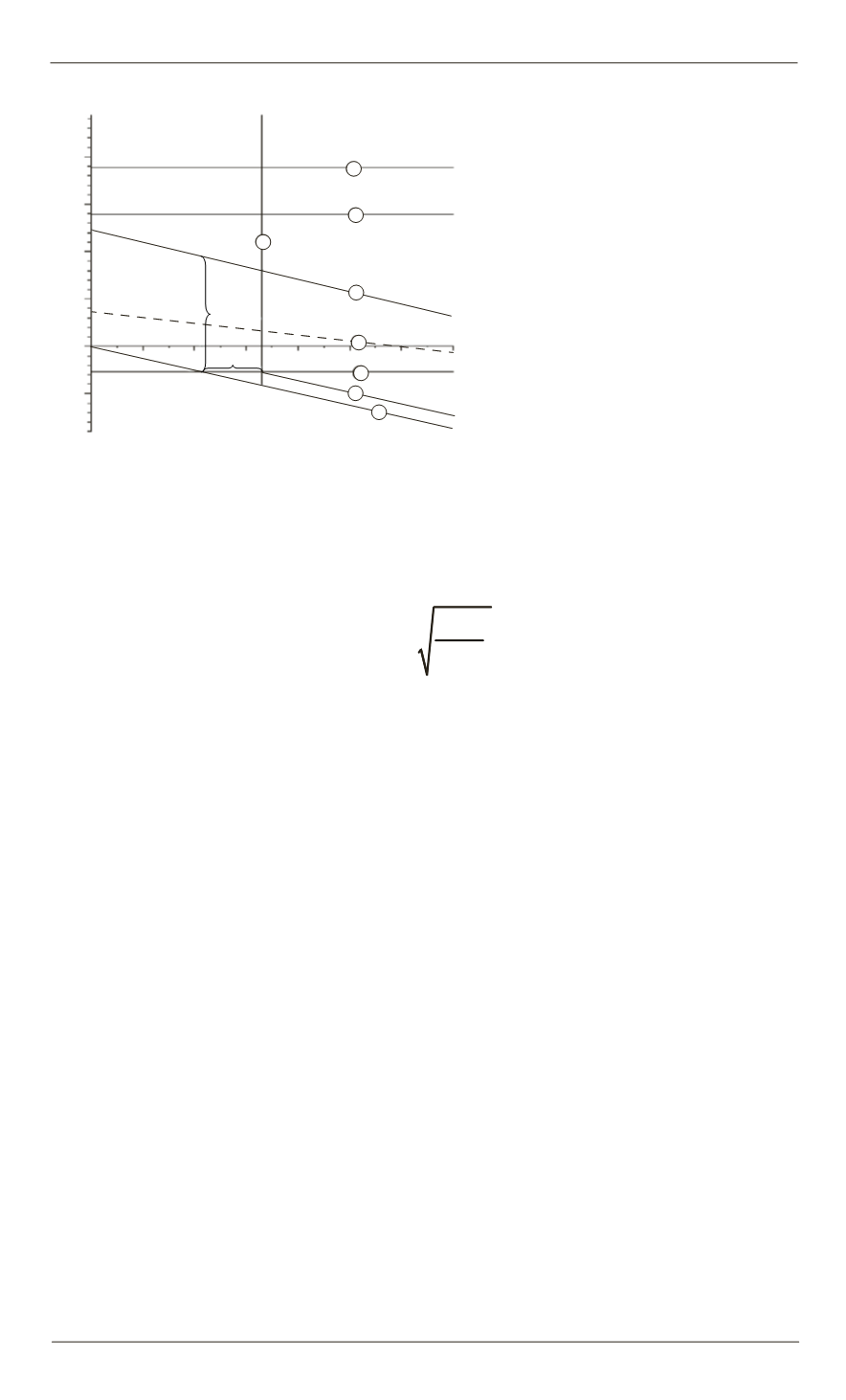
Диаграмма представлена на ри-
сунке. Линии соответствуют
процессам, представленным в
табл. 2.
Используя значение про-
изведения растворимости
Ni(OH)
2
, определяем концентра-
цию гидроксогрупп в растворе,
при которой происходит образо-
вание осадка труднораствори-
мого соединения Ni(OH)
2
:
2+
–
2
2
Ni(OH)
Ni
ОН
ПР =
,
a a
–
2+
OH
Ni
ПР = .
a
a
Величина рН образования осадка — 6,57 при стандартных услови-
ях. И так как растворимость веществ с ростом температуры возрастает,
концентрация гидроксогрупп при 323 К будет несколько выше данного
значения. Следовательно, при pH > 6,6 на электродах происходит осаж-
дение Ni(OH)
2
. И процесс никелирования прекращается. Можно до-
бавить линию, связанную с восстановлением никеля из твердой фазы
гидроксида никеля, но начало этой прямой возможно лишь от значений
рН = 6,57 в сторону увеличения рН раствора (линия 8).
Полученная диаграмма для приведенного выше состава показывает
принципиальную возможность осаждения никеля из раствора данного
электролита. Для этого нужно поддерживать рН среды в области
4,0 — 6,6. Теоретическое значение величины напряжения, достаточно-
го для начала электролиза — 1,164 В. При этом анодный процесс связан
с окислением воды, а катодный процесс — с восстановлением никеля.
Справедливо ожидать протекания реакции (4) на катоде (линия 2 на
рисунке) и возможно она протекает, но концентрация ионов Ni(OH)
+
в
10
4
раз меньше, чем ионов никеля, и вклад этого процесса будет незна-
чительным, поэтому на диаграмме этот процесс представлен пунктир-
ной линией 2.
Диаграмма Пурбе содержит только термодинамические данные.
Она не дает информации о скоростях реакций. В присутствии других
Рис. 1.
Исследование процесса никелиро-
вания с использованием диаграммы Пурбе
5
1
2
3
4
6
7
8
2 4 6 8 10 12 14
pH
U
pH
2,0
1,5
1,0
0,5
0
–0,5
, В


